APD和ERP 普罗帕酮的临床应用
上世纪80年代,普罗帕酮、氟卡尼等药物的应用,使I类抗心律失常药物发展到了顶峰,但90年代初,因I类抗心律失常药物升高器质性心脏病的总死亡率,学者转而开始关注III类抗心律失常药物。但对I类抗心律失常药物不利的临床研究都是针对心肌梗死、心衰的患者,只要患者心脏没有器质性病变,I类抗心律失常药物仍是临床必不可少的一线治疗药物。北京医院汪芳教授介绍了Ic类抗心律失常药物普罗帕酮的临床应用。
一、I类抗心律失常药物的分类
I类抗心律失常药物可分为3类,具体代表药物如表1。
表1 I类抗心律失常药物的分类

二、普罗帕酮作用机制
降低浦氏纤维及心室肌的自律性、减慢传导速度、延长APD和ERP;β受体阻滞作用;阻滞钙通道的作用。
三、普罗帕酮的药代动力学
普罗帕酮可被完全吸收,经CYP2D6酶系统代谢,其代谢能力是由遗传决定的。10%的患者代谢缓慢,半衰期较长。尽管其原形半衰期仅6小时,但因其活性代谢产物5-羟普罗帕酮半衰期较长,达到稳态血药浓度需72小时。应用较高剂量时,随血清浓度升高,与血浆蛋白结合减少,体内游离药物浓度呈非线性升高。
四、普罗帕酮的临床应用范围
1.室上性快速心律失常
房性心动过速、室上速心律失常(包括治疗及预防)、房颤或房扑、心律转复。
2.室性期前收缩
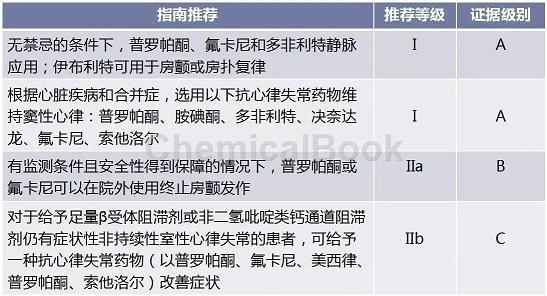
明确不伴有器质性心脏病的室性期前收缩、非心肌梗死器质性心脏病、无器质性心脏病基础的室速(特发性室速,发作或复发时皆可用普罗帕酮或氟卡尼)。2014年AHA/ACC/HRS房颤指南推荐如表2。
表2 2014年AHA/ACC/HRS房颤指南中抗心律失常药物的使用推荐
五、普罗帕酮的临床疗效
1.控制室早、成对室早、非持续性室速的有效率为48%~65%。
2.室上速和阵发性房颤有效率超过50%。
3.治疗无器质性心脏病房颤患者的主要一线药物,口服弹丸量600mg转复房颤。
4.目前还没有心肌梗死后和CHF时应用的安全性资料。
5.对旁道有抑制作用。
6.与地高辛合用:地高辛浓度升高40%~60%。
7.与华法林合用:使华法林血药浓度升高,延长INR。
六、普罗帕酮的用量用法
1.静脉用药
推荐起始剂量1~2mg/kgAPD和ERP,以10mg/min静推;单次通常为70mg,剂量不超过140mg。
2.口服
150mg tid或Q8h;3~4天后若无效,剂量可增加至200mg,200mg Q6h;QRS波增宽者慎用,剂量150mg tid。
七、普罗帕酮的不良反应
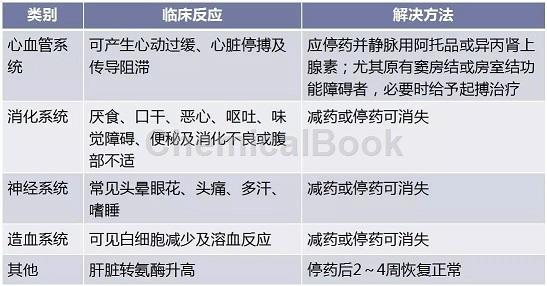
普罗帕酮常见的不良反应及处理方法如表3。
表3 普罗帕酮常见的不良反应及处理方法
用药后应定期监测心电图、血尿常规、肝肾功能等指标,必要时进行胸片、动态心电图、超声心电图等检查;门诊复查时认真询问相关的症状、进行细致的查体、与基线资料对比等非常重要,有助于及早发现、及时处理。
Ic类药物用于控制房颤或房扑时,可延长房内传导,减少房颤率;也可使房颤转变为房扑,反而造成更多的心房激动下传,加快心室率。其促心律失常作用多发生在用药24~48小时内,72小时后逐渐减少;发生促心律失常时应及时停药,测定血浆电解质浓度,包括血钾和血镁,并按具体心律失常处理;必要时可心室起搏,严重血流动力学障碍时可以电复律。Ic类药物造成的不间断性室速处理较难,可给乳酸钠或碳酸氢钠,必要时可应用利多卡因。
八、普罗帕酮的药物相互作用
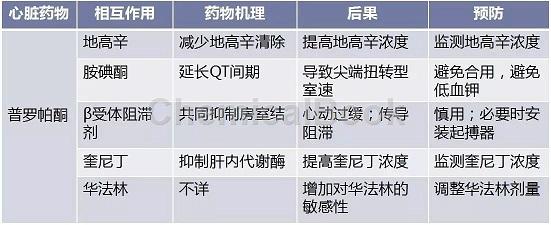
抗心律失常药物及药物的相互作用分为药效学及药代动力学两方面,可能相加而增强药物效用,也可能是作用相互抵消,甚至产生相反的结果而促心律失常。普罗帕酮与其他药物的相互作用如表4。
表4 普罗帕酮与其他药物的相互作用
总之,药物治疗仍是目前抗心律失常治疗的基石,是抗心律失常急性和长期维持治疗的首选;Ic类药物可作为非器质性心脏病患者抗心律失常的一线药物;普罗帕酮是目前最常用的Ic类药物,临床医生应掌握其正确、合理的使用方法。
点击图片查看OTC2023类器官前沿应用与3D培养论坛会后报告,OTC2024论坛征集投稿做报告,详询:王晨 180 1628 8769
类器官技术的出现与快速发展极大地提升了人造组织器官的制造水平,也为生物医药行业的发展带来全新机遇。作为一种新兴技术,其目前处于快速发展阶段,组织器官结构和功能的模拟水平在不断提高,在生物医学科研、临床治疗及药物研发中均已展现出可观的应用前景,尤其是在药物研发领域生物医药行业,相关产业体系正在逐渐成型,发展进程快速推进。
01 类器官简介
在2009年,Hans Clevers 实验室首次使用单个LGR5+肠干细胞在体外自组织 - self-organization成具有肠隐窝-绒毛结构的肠类器官,开启了类器官(Organoids)技术发展的新时代,肠类器官的形态见图1。2013年,日本、美国和奥地利的科研人员分别利用干细胞成功构建出肝脏、肾脏、大脑类器官,再次提升了该领域的关注度,Science杂志也将其评选为2013年十大突破。此后,类器官技术获得全球各国的广泛关注和竞相布局,短短几年内便实现了肺、胃、视网膜、输卵管、血管、胰脏、皮肤、心脏等多种类器官的构建。
类器官是具有器官关键性特征的三维(3D)细胞培养物,它包括一个自我更新干细胞群,可分化为多个器官特异性的细胞类型,与相对应的器官拥有类似的空间组织并能够重现对应器官的部分功能,从而提供一个高度生理相关系统[1]。
通俗来讲,类器官是在体外3D环境中培养生长的微型细胞簇,这些细胞簇在细胞因子、化学小分子抑制剂/激活剂、培养基及其他添加剂等物质作用下,经过自组织并分化为功能性细胞群,具有类似相应器官的组织结构和遗传学特点。类器官不是真正意义上的器官,但是它能够最大程度上模拟体内器官的结构和功能,并且能长期稳定传代培养。
图1:肠类器官培养[2]
类器官由两种类型细胞产生,一种是多能干细胞(Pluripotent stem cells,PSCs),例如胚胎干细胞(Embryonic stem cell,ESCs)、诱导多能干细胞(Induced pluripotent stem cells,iPSCs),另一种是器官限制性成体干细胞(Adult stem cell,ASCs)[3]。类器官所具有的关键特征是自组织 - self-organization,即可通过人为调控培养系统的成分,由细胞自主的分化为特定结构。
类器官进行更新和分化的物质基础是细胞因子和细胞外基质(Extracellular matrix,ECM),二者组成干细胞培养微环境。类器官培养基中的可溶性因子作为“肥料”可通过指导类器官细胞分化和增殖,促进类器官的形成。细胞因子的类别主要包括:促进细胞生长、分化相关通路的激活剂、抑制剂、激素以及促进细胞增殖的细胞因子。ECM作为类器官培养的3D支架,可形成具有生物学活性的三维基质,模拟体内细胞基底膜的结构、组成、物理特性和功能,构建与体内细胞微环境类似的机械特性和生理环境,利于体外细胞的生长、分化等功能的实现。
图2:类器官的形成[3]
02 类器官技术的应用
类器官技术的应用主要可以归纳为两方面,即作为替代的移植器官和作为生物模型。对于前者,类器官在肠道、肝脏、心脏等领域的研究较多,不过由于类器官非常复杂,对培养体系、血管系统、工程化等都有着较高的要求。当下大多尚处于早期研究阶段,且目前建立的能够替代移植器官的类器官存在结构不完整、体积较小、功能无法长期维持等关键问题,因此类器官在该方向的应用研究仍然有很长的路要走[4]。相比之下,类器官作为生物模型则是当前最主要的应用方向,在生物医学科研、临床医疗和药物研发等领域都已经展现出巨大的应用价值。
早在类器官技术开发的初期,研究人员便在小鼠模型中尝试使用肠道类器官修复受损的组织。在该研究中,科学人员成功地将上皮类器官原位移植到受体小鼠的结肠中,注入的类器官可以附着在受伤区域并与小鼠的上皮组织(即结肠内部的细胞层)相结合,最终形成了一个完好的上皮组织,该研究为使用结肠类器官移植治疗严重溃疡性结肠炎的人体临床试验提供了技术基础[5]。
另外,在前期研究中,类器官成功移植并在体内存活的研究仅局限于动物模型阶段,关于类器官在人体应用的安全性和有效性一直未见报道。2021年2月,《Science》首次报道了体外人体器官上进行类器官移植的成果。
通过将体外培养的胆道类器官移植到体外的人类肝脏中,来实现受损胆道的修复和再生[4],研究人员通过使用常温灌注系统,保障胆道损伤的肝脏在长时间离体条件下维持其生理功能,然后将胆囊类器官移植到肝内胆道中,发现移植物可保留在胆道腔室内并实现胆道的再生和胆汁性质的改善[6]。该研究首次证实了利用实验室中培养的类器官可以在人体器官上实现移植并发挥作用,开辟了人源类器官移植的新道路,为类器官移植应用于临床奠定了基础。
2022年7月,日本东京医科齿科大学研究团队将来自难治性溃疡性结肠炎患者自身的健康大肠黏膜组织进行体外培养,再将培养后的三维类器官移植到患者体内,再覆盖上可在人体内降解的薄膜加以固定,实现了患者自身的组织来修复受损黏膜的治疗效果。这是世界上首例针对难治性溃疡性结肠炎的类器官移植,也是首个将类器官移植到人体内的研究。
1.COVID-19
COVID-19是一种由SARS-CoV-2引起的传染病,可导致严重的急性呼吸综合征、高炎症反应和广泛的多器官损害。SARS-CoV-2的受体是血管紧张素转换酶2(Angiotensin converting enzyme 2,ACE2),其存在于多种人类细胞类型的细胞表面。SARS-CoV-2可以通过呼吸道感染肺部,导致肺损伤和气体交换受损[7]。
病毒如何进入人体不同组织的细胞,如何在宿主细胞内复制,宿主与病原体之间的相互作用,这些研究需要一个能展示组织结构组成信息及组织生理功能的模型,而肺类器官已被应用于SARS-CoV-2感染研究中,成为研究SARS-CoV-2感染病理生理学以及药物评估和体外毒理学研究的良好模型,下表展示了通过构建不同肺部类器官筛选出可治疗COVID-19的药物[8-9]。
表1肺类器官在新冠病毒中的研究[9]
由于ACE2受体在多组织中的广泛分布,SARS-CoV-2可以入侵多组织和器官,如大脑、肝脏、肾脏、眼等,研究显示SARS-CoV-2可以直接感染毛细血管类器官,这也证实了病毒可以通过全身传播造成多器官损伤[10-11]。源自其他组织的类器官也应用于SARS-CoV-2感染研究中。神经系统并发症在COVID-19患者中十分常见,表现为脑血管损伤、精神状态改变、头晕、头痛、味觉或嗅觉减退等,iPSCs来源的脑类器官揭示了SARS-CoV-2在神经系统中的感染机制[12]。
肝脏、肾脏损伤在重病患者中也很常见,利用iPSCs诱导分化形成肝脏类器官和胆管类器官,证实SARS-CoV-2可以感染肝胆类器官并引起趋化因子响应,这与COVID-19患者尸检样本中的趋化因子反应的结果一致[13]。此外,ESCs诱导分化形成的眼类器官模型证实SARS-CoV-2在眼部的感染,尤其是角膜缘区域,这为眼表细胞可以被呼吸道飞沫直接感染提供了证据[8]。
2.肿瘤类器官
临床试验中抗癌药物的失败率极高,能够通过I~III期临床试验的药物仅为3.4%,缺乏合适的模型或药物的疗效差及不良反应是其失败和退出市场的主要原因。肿瘤细胞系和患者来源的异种移植模型(Patient-derived tumor xenograft,PDX)是癌症研究和抗癌药物筛选中最常用的模型,但存在着遗传不稳定、缺乏肿瘤微环境等缺点[14]。
类器官模型作为一种新型的肿瘤研究模型具有显著的优势,与细胞系相比,类器官具有模拟原始组织的3D结构、异质性和细胞功能等方面的优势,能更好地模拟人类疾病和预测药物反应;与PDX相比,类器官可以快速扩增、冷冻保存并可以进行高通量分析(图3)。因此,肿瘤类器官在评价药物的疗效和毒性,精准治疗等方面拥有巨大的潜力。
图3:类器官与其他临床疾病研究模型对比优势显著[14]
a)评价药物的疗效/毒性
在肿瘤免疫治疗中,肿瘤微环境(Tumor microenvironment,TME)中肿瘤和免疫细胞的相互作用对临床前评估至关重要,没有肿瘤微环境的存在,就无法准确评估免疫治疗中潜在的药物有效性[15]。研究发现肿瘤类器官与自体外周血淋巴细胞共培养时,在肿瘤类器官的刺激下,具有患者特异性免疫基因突变的肿瘤反应性T细胞会不断扩增进而识别并杀死自体肿瘤类器官[14,16]。
美国印第安纳大学Xiongbin Lu教授课题组基于小鼠或患者来源的乳腺肿瘤类器官和肿瘤特异性细胞毒性T细胞功能相互作用的高通量筛选,鉴定出可促进抗原提呈和增强T细胞介导的细胞毒性的表观遗传抑制剂。该研究使用乳腺肿瘤类器官和肿瘤特异性细胞毒性T细胞(CD8+T细胞)共培养,来模拟小鼠体内肿瘤微环境(图4)。经过高通量筛选,从141种相关化合物中筛出了3种能够促进抗原提呈和增强T细胞介导的细胞毒性的表观遗传抑制剂[17]。
图4:肿瘤类器官共培养模拟体内微环境[17]
b)精准医疗
以“Organoid”“类器官”为关键词分别在clinicaltrials.gov和中国临床试验注册中心检索发现:截至2023年10月,在clinicaltrials.gov类器官相关临床试验数量共计182项,在中国注册类器官相关临床试验数据共计48项。通过检索,这些临床试验基本都是基于患者来源的肿瘤类器官(Patient-derived organoids,PDOs)模型用于该患者的药物筛选或药敏试验,即对临床患者实现精准医疗的治疗效果。临床试验集中在发病率和死亡率较高的瘤种,如结直肠癌、肺癌、乳腺癌、肝癌和胰腺癌等。基于肿瘤类器官的药敏检测以指导临床用药是肿瘤类器官的一大发展方向。表2和表3列举了在国内外已备案登记的使用肿瘤类器官实现精准医疗的个别案例。
表2 国内已登记的类器官临床试验案例
表3 国外已登记的类器官临床试验案例
03类器官技术的发展现状
类器官是一个实验室科研与产业转化衔接非常紧密的领域,尤其是在药物研发方面,目前已经初步形成了产业体系,一方面从早期开展类器官研发的领先机构中,衍生出一批专注于类器官研发的企业,并成为了类器官领域的领军企业 [18]。另一方面,多家全球知名的大型药物企业纷纷开始进军这一领域,通过与类器官研发公司合作,或建立类器官研发部门,在新药研发中引入类器官技术(表4),实现药物研发流程优化。
表4 药物研发企业与类器官企业合作案例[18]
2022年,类器官领域的产业化发展迎来了里程碑,赛诺菲利用Hesperos开发的体外微生理系统(类器官芯片),针对两种罕见的自身免疫性疾病开展了临床前研究,于同年8月获得的研究数据获得了美国食品药品管理局(FDA)的认可,批准了药物HRS-1893片进入临床试验(临床试验编号:NCT04658472)。
该类器官芯片由人诱导多能干细胞(iPSC)衍生的运动神经元和人施万细胞(周围神经系统中的神经胶质细胞称)组成。通过添加由赛诺菲开发的抑制经典补体途径的抗体TNT005,降低了其功能模型中的传导速度和动作电位放电频率,以测试候选药物对罕见病患者的疗效。这是全球首个完全基于体外微生理系统研究获得临床前数据的新药获批进入临床试验。同年12月,FDA现代化法案2.0版取消了在药物开发过程中强制性的动物实验,这一政策变化将大大推动器官芯片、类器官等一系列新技术的发展。
我国类器官领域的研发起步相比欧美国家晚,早期没有进行全面布局,导致我国该领域研究人员的体量和研究规模均较小,研究基础积累相对薄弱,相比国际领先水平具有不小的差距[18]。但“十三五”以来,这一形势开始发生变化,我国开始对类器官领域进行布局,促进了我国类器官领域从技术研发到临床和产业应用的全面发展。
2021年1月28日,科技部下发的《关于对“十四五”国家重点研发计划6个重点专项2021年度项目申报指南征求意见的通知》中,把“基于类器官的恶性肿瘤疾病模型”列为“十四五”国家重点研发计划中首批启动重点专项任务。另外,“十四五”国家重点研发计划中重点指出,类器官作为一项重大的技术突破被用于疾病模型的建立中,且可用于研究病理状态下干细胞变异、异质性及其发生机理,挖掘疾病诊疗的新靶标,探索诊疗新策略。
近年来,国家自然科学基金也对类器官领域给予了大力支持,重点项目中设置了“组织工程及类器官仿生构筑”“基于生物活性材料的空间特征化类器官构建及再生修复研究”等资助方向,并在多个重大研究计划项目、重大项目的指南中提出鼓励开发和利用类器官技术,开展各种生物医学领域机制调控研究。
04 总结
类器官培养技术目前正处于技术爆发和科研成果井喷的阶段,已成为神经科学、肿瘤学和消化病学等多个领域的药物发现、疾病建模和基础研究的重要工具,行业发展具有很大的前景。然而,这同时也面临较大的挑战,比如目前大多类器官本身并不具备血管化的结构,随着类器官体积的增长,类器官受限于氧气的缺失以及代谢废物的增加,可能导致的组织坏死。
此外,重复性和一致性也是类器官发展的重大瓶颈,这很大程度上是由于过程控制的欠缺与行业标准的空白。因此,类器官技术目前仍处于早期的阶段,还需进一步的研究和开发,以充分实现其潜力。
参考文献
[1] 中国研究型医院学会.《人肝祖细胞类器官构建、质量控制与保藏操作指南》(T/CRHA 017-2023)
[2] Sato T , Vries R G , Snippert H J ,et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche.Nat.2009; 459:262–265.
[3] Kim J, Koo B-K, Knoblich J A. Human organoids: model systems for human biology and medicine. Nat Rev Mol Cell Biol. 2020 Oct; 21(10):571-584.
[4] 赵冰.类器官在器官移植领域的应用前景[J].器官移植,2022,13(02):169-175.
[5] Watanabe S, Kobayashi S, Ogasawara N, et al. Transplantation of intestinal organoids into a mouse model of colitis. Nature Protocols, 2022: 1-25.
[6] Sampaziotis F , Muraro D , Tysoe O C ,et al. Cholangiocyte organoids can repair bile ducts after transplantation in the human liver. Science, 2021, 371(6531):839-846.
[7] Wang D, Hu B, Hu C, et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China. JAMA, 2020, 323: 1061–1069.
[8]王婷,范时盼,陈晔光.类器官:新冠病毒研究新模型[J].中国科学:生命科学,2023,53(02):238-249.
[9] Han, Y., Yang, L., Lacko, L.A. et al. Human organoid models to study SARS-CoV-2 infection. Nat Methods 2022, 19: 418–428.
[10] Hikmet F, Loren Méar, Edvinsson S, et al. The protein expression profile of ACE2 in human tissues. Mol Syst Biol, 2020, 16: e9610
[11] Monteil V, Kwon H, Prado P, et al. Inhibition of SARS-CoV-2 infections in engineered human tissues using clinical-grade soluble human ACE2. Cell, 2020, 181: 905–913.e7
[12] Tiwari S K, Wang S, Smith D, et al. Revealing tissue-specific SARS-CoV-2 infection and host responses using human stem cell-derived lung and cerebral organoids. Stem Cell Rep, 2021, 16: 437–445.
[13] Yang L, Han Y, Nilsson-Payant B E, et al. A human pluripotent stem cell-based platform to study SARS-CoV-2 tropism and model virus infection in human cells and organoids. Cell Stem Cell, 2020, 27: 125–136.e7
[14]马烁烁,张登勇,马杨等.类器官技术在肿瘤研究中的进展[J].牡丹江医学院学报,2023,44(01):148-151.
[15] Neal J T , Li X , Zhu J ,et al. Organoid Modeling of the Tumor Immune Microenvironment. Cell. 2018; 175(7):1972-1988.e16.
[16] Cattaneo CM, Dijkstra KK, Fanchi LF, et al. Tumor organoid-T-cell coculture systems. Nat Protoc. 2020; 15(1):15-39.
[17] Zhou Z, Jeught K V D, Fang Y ,et al. An organoid-based screen for epigenetic inhibitors that stimulate antigen presentation and potentiate T-cell-mediated cytotoxicity. Nat Biomed Eng. 2021 Nov; 5(11):1320-1335.
[18] 王玥,施慧琳,靳晨琦等.类器官领域发展现状及展望[J].中国生物工程杂志,2023,43(08):1-10.
药政法规事务部
CLIN-NOV
致力于为化学药品、生物制品等提供覆盖其整个生命周期的临床前项目管理及注册申报服务,同时负责临床项目的遗传办申报,致力于更快地推进临床试验的启动,助力药物开发与快速上市。
可以精准把握注册要点,解读NMPA、FDA、科技部政策法规,并践行申报资料的具体要求,遵守统一的SOP规程,多层次、全方位保持与申办方及审评人的双向有效沟通,保证项目进程的高效推进。新药部目前申报获批IND批件40余个,申报通过的遗传办100余项。
点击图片查看OTC2023类器官前沿应用与3D培养论坛会后报告,OTC2024论坛征集投稿做报告,详询:王晨 180 1628 8769



